كيف يعمل تطوير الأدوية المدعومة بالذكاء الاصطناعي على إعادة تشكيل البحوث الصيدلانية

جدول المحتويات
لقد اجتاح الذكاء الاصطناعي التوليدي العالم. لقد تم إحراز تقدم كبير في مجال الذكاء الاصطناعي على مدى العقدين الماضيين، ويتم تطبيقه الآن بشكل روتيني في العديد من الصناعات، حيث تغطي تطبيقات الذكاء الاصطناعي الحالية مجموعة واسعة من الأنشطة، بما في ذلك التعرف على الصور، والتنقيب عن مجموعات البيانات الكبيرة وغير المنظمة، والتعلم الشخصي، وغيرها الكثير.
من المؤكد أن الاختراقات في نماذج اللغات الكبيرة، مثل GPT-4، أعادت تعريف التفاعلات بين الإنسان والحاسوب. إن تطوير الأدوية ليس استثناءً من هذه الاتجاهات الأوسع التي نراها في الذكاء الاصطناعي، لا سيما بالنظر إلى الارتفاع الحاد في تكاليف تطوير الأدوية الجديدة.
مقابل كل دواء جديد يتم طرحه في السوق، يكلف 6.16 مليار دولار ويأخذ أكثر من 10 سنوات من العمل. وبالتالي، فإن الاستراتيجيات التي يمكن أن تسهل وتسرع عملية تطوير الأدوية تحظى باهتمام كبير.
في هذه المقالة، نغطي استخدامات الذكاء الاصطناعي في عملية تطوير الأدوية، ونفصل التحديات والفرص الرئيسية في صناعة الأدوية الحيوية، ونقدم أمثلة واقعية للذكاء الاصطناعي في العمل.
فهم تطوير الأدوية
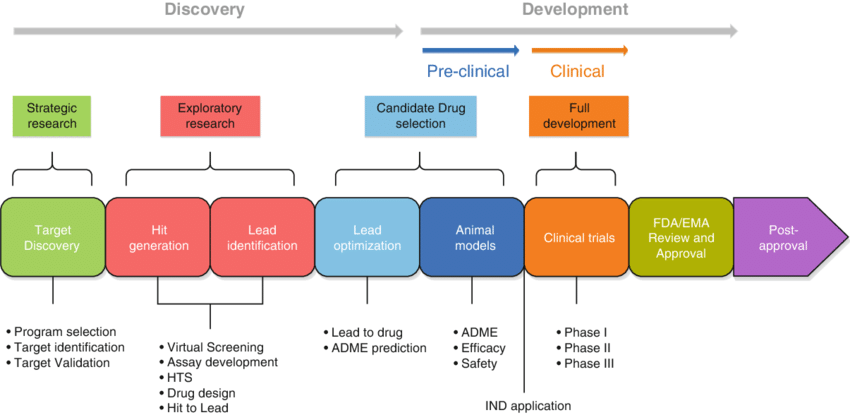
تتضمن عملية تطوير الدواء إدخال جزيء دوائي جديد في الاستخدام السريري. وبأوسع معانيه، يشمل هذا جميع المراحل، بدءًا من البحث الأولي لتحديد الهدف الجزيئي المناسب، وصولاً إلى دعم إطلاق الدواء في السوق.
يعد إنشاء دواء جديد وإدخاله إلى السوق مستهلكًا للوقت ومكلفًا. يعتمد نجاح الدواء الجديد بشكل كبير على التعاون القوي والتآزر بين العديد من الإدارات داخل منظمة تطوير الأدوية والباحثين الخارجيين ومقدمي الخدمات، في حوار مستمر مع السلطات التنظيمية والخبراء الأكاديميين والأطباء ومنظمات المرضى.
عبر المراحل المختلفة من دورة حياة الدواء، يبرز تطوير الدواء باعتباره الجانب الأكثر أهمية لكل من انتصاره الأولي والمستدام في السوق.
وصلت النفقات المقدرة للبحث والتطوير المرتبط بكل دواء فعال إلى 6.16 مليار دولار في عام 2023. يشمل هذا التقدير المالي التكاليف المتكبدة بسبب العديد من حالات الفشل التي تمت مواجهتها على طول الطريق. من بين كل 5,000 إلى 10,000 مركب يدخل مرحلة التقييم والتطوير، يحصل واحد فقط على الموافقة في نهاية المطاف.
تمثيل تخطيطي لعملية اكتشاف الدواء
قد تبدو هذه الأرقام مذهلة، لكن الفهم الموجز لعملية البحث والتطوير يمكن أن يلقي الضوء على سبب فشل العديد من المركبات في التقدم ولماذا يلزم بذل جهد كبير لتقديم دواء واحد للمرضى.
تعزيز تطوير الأدوية باستخدام الذكاء الاصطناعي
تؤثر التكاليف المرتفعة والتأخير والفشل في التجارب السريرية سلبًا على المرضى. على الرغم من العديد من التطورات، لا يزال عدد كبير من الأمراض يفتقر إلى العلاجات الدوائية الفعالة. هذا يجعل إيجاد طرق أفضل وأسرع لإجراء التجارب السريرية أمرًا بالغ الأهمية.
النقطة البارزة هي أن الذكاء الاصطناعي يستخدم بشكل أكثر شيوعًا في اكتشاف أدوية جديدة مقارنة باستخدامه في التطوير السريري. هذا لأن اكتشاف الأدوية يتضمن اختبار عقاقير جديدة محتملة على الخلايا والحيوانات، وليس له نفس اللوائح الصارمة مثل الاختبار على الأشخاص.
ومع ذلك، فإن المزيد والمزيد من المؤسسات الأكاديمية وشركات الأدوية الحيوية وشركات التكنولوجيا الحيوية الأصغر تدرك إمكانات الذكاء الاصطناعي لإحداث ثورة في التجارب السريرية.
يمكن للذكاء الاصطناعي تحويل مختلف المراحل المهمة من التجارب السريرية، من التخطيط إلى التنفيذ، مما يؤدي إلى معدلات نجاح أفضل والحد من تحديات البحث والتطوير في مجال الأدوية الحيوية.
في الأقسام التالية، نستكشف حالات استخدام الذكاء الاصطناعي المختلفة في عملية تطوير الدواء.
تصميم الدراسة
تتبنى شركات الأدوية الحيوية أساليب مختلفة لابتكار التجارب السريرية. ولتحقيق الفعالية، تعتمد هذه الاستراتيجيات على كميات متزايدة من البيانات العلمية والبحثية من مصادر متنوعة مثل التجارب السريرية السابقة والجارية، وبرامج دعم المرضى، ومراقبة ما بعد السوق. يمكن للذكاء الاصطناعي المطبق على بيانات العالم الحقيقي (RWD) استخراج أنماط ذات مغزى من هذه المعلومات، مما يعزز تصميم التجارب السريرية.
علاوة على ذلك، يمكن استخدام تقنية الذكاء الاصطناعي ومعالجة اللغة الطبيعية لتحديد واختيار نقاط النهاية الأولية والثانوية المثلى في تصميم البحث لضمان إنشاء البروتوكولات الأكثر صلة باستخدام مجموعات بيانات الرعاية الصحية. يتيح تصميم الدراسة الأكثر دقة دورات تطوير البروتوكول الأقصر، والمزيد من النتائج التي يمكن التنبؤ بها، ومعدلات التوظيف المحسنة، وزيادة الكفاءة طوال التجربة.
على سبيل المثال، يمكننا أن ننظر إلى شراكتنا مع شركة أبحاث فارما رائدة باستخدام تحليلات RWE المتقدمة للكشف الروابط بين الأرق والعلاجات والإعاقات النهارية. قمنا ببناء أنطولوجيا تعتمد على البيانات لتوصيف منطقة مرضية معينة وقمنا بتطبيقها لفهم نتائج المرضى في العالم الحقيقي بشكل أفضل. من خلال تحليلات RWE المتقدمة، حصلت الشركة على بيانات من 80,000 مريض في غضون 4.5 ساعة فقط، متجاهلة مراجعات الرسوم البيانية التي تستغرق وقتًا طويلاً. وقد أدى ذلك إلى زيادة جودة البيانات وموثوقية الدراسات الناتجة، بما يتوافق مع موثوقية التجارب السريرية.
إجراء التجارب السريرية
في السنوات القليلة الماضية، ظهرت بعض الحلول المبتكرة لتحسين إجراء التجارب السريرية.
واحدة من هذه الأسلحة هي أسلحة التحكم الاصطناعية. SCAs هي أذرع تحكم خارجية يستخدم فيها الباحثون البيانات لإنشاء تحكم افتراضي أو اصطناعي بدلاً من تجنيد مرضى جدد لمجموعة تحكم. يتضمن بناء SAC استخدام بيانات المريض الموجودة في مجموعات البيانات الموجودة مسبقًا، مثل السجلات الصحية الإلكترونية (EHR)، والبيانات التي تم إنشاؤها بواسطة المريض من أجهزة تتبع اللياقة البدنية، أو المعدات الطبية المنزلية، التي يتم تجريدها من أي معلومات تعريف شخصية.
ثم يتم استخدام هذه البيانات لنمذجة أو محاكاة النتائج المتوقعة ومقارنتها مع تلك الموجودة في التجربة السريرية. إن إلغاء أو تقليل الحاجة إلى أذرع التحكم العادية يضمن حصول جميع المشاركين على العلاج الفعال، مما يزيل المخاوف بشأن مهمة العلاج. علاوة على ذلك، يمكن لأذرع التحكم الاصطناعية زيادة الكفاءة وتقليل التأخير وخفض تكاليف التجارب وتسريع دخول الأسواق للعلاجات.
إضافة حديثة أخرى إلى مشهد الابتكار هي نقاط النهاية الرقمية. عند السعي للحصول على موافقة إدارة الغذاء والدواء الأمريكية (FDA) على دواء جديد، يُطلب من الشركات المصنعة تقديم أدلة قوية على تأثيره المفيد سريريًا على المرضى. غالبًا ما تستند هذه الأدلة إلى نقاط النهاية مثل البقاء على قيد الحياة أو التخفيضات الكبيرة في العلامات الحيوية مثل كوليسترول البروتين الدهني منخفض الكثافة أو الهيموجلوبين A1c.
تمثل نقاط النهاية الرقمية أحدث تطور في هذا المجال. يتم تقييم نقاط النهاية هذه باستخدام البيانات التي تم جمعها بواسطة أجهزة الاستشعار، عادةً خارج الإعدادات السريرية وأثناء الروتين اليومي. يمكن أن تتخذ هذه المستشعرات عادةً شكل أجهزة قابلة للارتداء، مثل مقاييس التسارع في الساعات الذكية التي تلتقط بيانات الحركة.
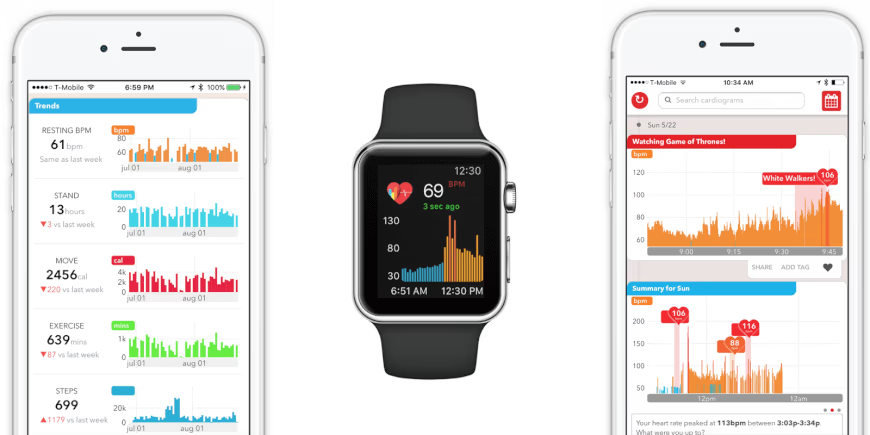
تستخدم الأجهزة القابلة للارتداء خوارزميات خاصة بالأمراض لمعالجة بيانات المشاركين، مما يوفر رؤى أكثر دقة حول المؤشرات الحيوية الرقمية. في دراسة مرض باركنسون، قد تحدد الخوارزميات المصممة شدة الأعراض وتطورها، بما في ذلك الحركات اللاإرادية والرعشة وأنماط المشي.
في حين أن نقاط النهاية التقليدية والمؤشرات الحيوية لا تزال ضرورية لتقديمات ولوائح إدارة الغذاء والدواء، فإن المؤشرات الحيوية الرقمية تقدم للجهات الراعية معلومات سياقية، مما يتيح اتخاذ قرارات واثقة وفعالة. على سبيل المثال، يمكن أن تشير المؤشرات الحيوية الرقمية المبتكرة إلى احتمال فشل تجربة المرحلة الثالثة، والذي قد لا تكتشفه نقاط النهاية التقليدية.
توظيف المرضى
يشكل العثور على مواقع تجريبية مناسبة لإجراء البحوث السريرية بفعالية مع الوصول إلى عدد كافٍ من المرضى المؤهلين تحديًا مستمرًا. نظرًا لأن الدراسات تستهدف عددًا أقل من المرضى، يصبح تحقيق أهداف التوظيف أكثر صعوبة، مما يؤدي إلى زيادة التكاليف، والجداول الزمنية الأطول، وزيادة فرص الفشل.
تظهر الأبحاث أن 37٪ من المواقع لا تحقق هدف التسجيل الخاص بها، بينما تفشل 11٪ من المواقع في تسجيل مريض واحد. يمكن أن يساعد الذكاء الاصطناعي والتعلم الآلي (ML) في التخفيف من هذه التحديات من خلال تحديد المواقع ذات أفضل إمكانات التوظيف واقتراح استراتيجيات التوظيف المناسبة. يتضمن ذلك رسم خرائط لمجموعات المرضى والاستهداف الاستباقي للمواقع ذات الإمكانات العالية المتوقعة لتجنيد معظم المرضى - حتى قبل فتح أي موقع - وتحديد الأساليب المثلى لجذبهم.
يعد تحليل محتوى وسائل التواصل الاجتماعي أحد أكثر الأجزاء تقدمًا في استخدام الذكاء الاصطناعي في تحديد المرضى وتوظيفهم. يمكن استخدام الذكاء الاصطناعي للتنقيب من خلال المنتديات عبر الإنترنت حيث يتبادل المرضى المعلومات حول حالاتهم لاكتشاف ما إذا كانت هناك مواقع أو مناطق معينة قد تكون فيها الحالة الطبية أكثر انتشارًا. يساعد هذا النهج منظمي التجارب السريرية على تسريع تحديد المجموعات، مما سيساعد الشركات على تصميم التجارب السريرية بفعالية.
.avif)
تم اختبار هذا النهج بالفعل من قبل شركة استشارية مقرها ملبورن ساعدت مؤخرًا دراسة عصبية في حالات الضائقة في تحديد مرضى الزهايمر بعد تلقي اهتمام من مجموعات الدراسة المحتملة التي لم يكن لديها تشخيص واضح. من خلال استخدام التكنولوجيا التنبؤية وتحليل المؤشرات الحيوية الرقمية في سلوك المجموعة على وسائل التواصل الاجتماعي، حددوا الأشخاص الذين تم تشخيصهم بمرض الزهايمر وتوقعوا موقعهم الجغرافي.
المراقبة السريرية
يمكن أن تلعب الخوارزميات أيضًا دورًا في مراقبة المرضى والإشراف عليهم من خلال أتمتة التقاط البيانات ورقمنة التقييمات السريرية القياسية ومشاركة البيانات عبر الأنظمة المختلفة.
علاوة على ذلك، يمكن لحلول الذكاء الاصطناعي أن تساعد الممرضات والأطباء في تحديد الإجراءات اللازمة وفقًا لمتطلبات البروتوكول، بما في ذلك الاختبارات السريرية المحددة وإجراءات مراقبة المؤشرات الحيوية التشخيصية، والمساعدة في جدولة زيارات المرضى، وتعبئة بيانات المريض مسبقًا في أنظمة EDC.
خلال معظم التجارب السريرية، تقتصر نظرة الباحثين على صحة المرضى على الزيارات الميدانية المجدولة. وبالتالي فإن القياس الدقيق لالتزام المريض بخطة العلاج يمثل تحديًا. يمكن أن يؤدي هذا التفاوت إلى اختلافات بين فعالية العلاج في التجارب السريرية وتأثيرات الأدوية في العالم الحقيقي. يمكن لخوارزميات الذكاء الاصطناعي المتقدمة، التي تستخدم البيانات التي تم جمعها من خلال الأجهزة القابلة للارتداء والتطبيقات وأجهزة الاستشعار من المشاركين في التجربة، تقديم رؤى في الوقت الفعلي حول سلامة العلاج وفعاليته. والأهم من ذلك، أن هذه التطبيقات والأجهزة المتصلة تمكّن المرضى من تلقي المعلومات والدعم في الوقت الفعلي، مما قد يعزز المشاركة والاحتفاظ.
إحدى المبادرات التي في طريقها لتعطيل الوضع الراهن هي تطبيق Novartis FocalView، الذي تم إطلاقه في عام 2018. تم تطوير التطبيق من خلال ResearchKit من Apple لاستخدامه كمنصة أبحاث رقمية لطب العيون ويهدف إلى جعل التجارب السريرية لطب العيون أكثر سهولة ومرونة من خلال السماح للباحثين السريريين بمراقبة تطور المرض من خلال جمع البيانات المبلغ عنها ذاتيًا في الوقت الفعلي مباشرة من المرضى الموافقين. تم إطلاق هذا التطبيق في App Store في الولايات المتحدة ليتم اختباره في دراسة مستقبلية غير تدخلية لتقييم سهولة استخدامه وقدرته على جمع البيانات السريرية المهمة والوثائق الأخرى، بما في ذلك الموافقة المستنيرة.
التحديات في اعتماد الذكاء الاصطناعي في الصيدلة الحيوية
يحمل تكامل الذكاء الاصطناعي وعدًا كبيرًا لإحداث ثورة في صناعة الأدوية الحيوية. ومع ذلك، إلى جانب هذا الحماس، هناك تحديات معقدة تتطلب دراسة متأنية وحلولًا استراتيجية.
الحاجة إلى بيانات موثوقة
تحتاج تقنيات الذكاء الاصطناعي إلى بيانات موثوقة لتدريب خوارزمياتها بشكل فعال وجعل المستخدمين يشعرون بالثقة في مدى نجاح التكنولوجيا. يجب تحديد هذه البيانات وإعدادها وتخزينها بطريقة تجعل من السهل تحليلها. ومع ذلك، فإن الكميات الكبيرة من البيانات التي تنتجها صناعة الأدوية الحيوية غالبًا ما تكون فوضوية، مما يجعل من الصعب استخدامها بفعالية. يمكن أن تختلف جودة مصادر البيانات وموثوقيتها كثيرًا، وقد تكون البيانات في شكل نص أو صوت أو فيديو أو صور، والتي تكافح تقنيات الذكاء الاصطناعي الحالية أحيانًا لفهمها دون مساعدة من البشر المهرة.
نظرًا لأن البيانات هي العملة الجديدة في مجال علوم الحياة، فإن شركات الأدوية الحيوية في سباق للحصول على أكبر قدر ممكن من البيانات. ويقومون بذلك من خلال الشراكة والتعاون والاندماج مع الشركات الأخرى، أو بناء قدراتهم الخاصة. من المهم لشركات الأدوية الحيوية التأكد من السماح بأي بيانات للمرضى تستخدمها للغرض المحدد والحفاظ عليها خاصة وآمنة. من الضروري أيضًا تحسين كيفية مشاركة المعلومات بين جميع المعنيين حول المشكلات والحوادث والمخاطر وأفضل الممارسات والاستراتيجيات للتعامل معها.
والخبر السار هو أن نهجًا جديدًا للتدريب على الذكاء الاصطناعي، والمعروف باسم التعلم الفيدرالي، مهيأ لتبسيط عملية نماذج التدريب ببيانات شاملة من خلفيات جغرافية وعرقية واجتماعية واقتصادية متنوعة. من خلال التعلم الموحد، يرسل الباحثون نموذج الذكاء الاصطناعي الخاص بهم إلى مواقع البيانات الخارجية - مثل الجامعات أو أنظمة الرعاية الصحية - ويقومون ببساطة بجمع الدرجات المرجحة بمجرد تدريب النموذج على البيانات الخارجية. ونتيجة لذلك، تظل البيانات مع مالكيها المعنيين، مما يبسط الامتثال للوائح خصوصية البيانات، ويقلل من الخطوات الإدارية، ويقلل من نفقات الحصول على البيانات.
.avif)
من المهم أن ندرك أن التعلم الموحد لا يخلو من القيود. في السيناريوهات المثلى حيث يتم توزيع البيانات بشكل مستقل ومتماثل (iid)، يعمل التعلم الموحد على قدم المساواة مع نماذج المجموعات. ومع ذلك، فإن البيانات المقسمة على طول الحدود الوطنية تفتقر إلى خاصية iid بسبب الاختلافات الكبيرة في المرضى وأنظمة الرعاية الصحية عبر البلدان. تحتفظ كل مجموعة بيانات بالتحيزات داخل الصومعة الخاصة بها وتصدر هذه التحيزات إلى جميع المجموعات عبر النماذج المشتركة.
على سبيل المثال، في عام 2019، كانت النسبة المعيارية للعمر للبالغين المصابين بداء السكري 3.2٪ في أيرلندا، و 10.4٪ في ألمانيا. قد تقوم مجموعة نماذج FL التي تغطي كلا البلدين بالإفراط في تشخيص مرض السكري في أيرلندا ونقص تشخيص مرض السكري في ألمانيا. تم اقتراح العديد من الحلول لمواجهة تحدي توزيع البيانات غير iid، مما أدى إلى درجات مختلفة من الفعالية؛ ومع ذلك، فإن هذه التحسينات لم تحقق بعد الدقة التي حققها إطار ML المركزي.
ترقية البيانات والبنية التحتية لتكنولوجيا المعلومات
تعتمد تقنيات الذكاء الاصطناعي على البيانات في عملية التعلم الخاصة بها، وتلعب التطورات في أنظمة الكمبيوتر والبنية التحتية الأساسية المسؤولة عن تنفيذ الخوارزميات - التي تشمل الأجهزة والبرامج والخدمات - دورًا محوريًا في تسهيل نمو الذكاء الاصطناعي. يتطلب تنفيذ تقنيات الذكاء الاصطناعي الإعداد والتدريب والمساعدة.
يمكن أن يكون إدخال أجهزة وبرامج الذكاء الاصطناعي ودمجها في إطار تكنولوجيا المعلومات الحالي لشركة الأدوية الحيوية مهمة معقدة تتطلب خبرة متخصصة، وهو مورد يعاني حاليًا من نقص في العديد من شركات الأدوية الحيوية. وبالمثل، فإن توفير خدمات الدعم والصيانة لدعم البنية التحتية لتكنولوجيا المعلومات أو ترقيتها إلى مستوى مقبول يمكن أن يشكل أيضًا تحديات من حيث التكاليف والوقت اللازم للحفاظ على التحديث.
الاعتبارات الأخلاقية
في حين أن الذكاء الاصطناعي يمكن أن يجعل التجارب السريرية أسرع وأرخص وأكثر دقة، إلا أنه من السهل التغاضي عن آثاره الأخلاقية في الإثارة بشأن الإمكانات. يدور أحد المخاوف الملحة حول خصوصية البيانات. نظرًا لأن نماذج الذكاء الاصطناعي تتطلب قدرًا كبيرًا من البيانات للعمل بشكل موثوق، فإن تدريب نماذج الذكاء الاصطناعي عادة ما يستلزم تزويدها بكميات كبيرة من السجلات الطبية التي يتم دمجها في قاعدة بيانات موحدة للتحليل. ومع ذلك، فإن الاحتفاظ بمثل هذا المستودع الضخم من المعلومات الحساسة ينطوي على مخاطر كبيرة للأمن السيبراني والخصوصية.
تمثل احتمالية التحيز في نماذج الذكاء الاصطناعي مشكلة أخلاقية أخرى. إذا كانت بيانات التدريب تحتوي على تحيزات متأصلة، يمكن لخوارزميات الذكاء الاصطناعي أن تتعلم وتديم هذه التحيزات في عمليات صنع القرار. في سياق تطوير الأدوية، قد تؤدي بيانات التدريب المتحيزة إلى تنبؤات أو توصيات منحرفة، مما يؤثر على نتائج العلاج ورعاية المرضى.
أخيرًا، يمكن لطبيعة «الصندوق الأسود» لبعض أنظمة الذكاء الاصطناعي أن تقوض الشفافية، مما يجعل من الصعب شرح كيفية استخدام النموذج للبيانات. وهذا يعيق الموافقة المستنيرة في التجارب السريرية، مما يسلط الضوء على الحاجة إلى تدابير الشفافية المعززة لتعزيز الثقة والمساءلة.
لوائح التنقل
تعمل صناعة الأدوية الحيوية في مشهد تنظيمي معقد بشكل متزايد. على مدى السنوات القليلة الماضية، كان هناك ارتفاع ملحوظ في التعديلات التنظيمية داخل الصناعة، مع وجود العديد من اللوائح القادمة التي لم يتم سنها بعد. في الوقت نفسه، تواجه السلطات التنظيمية مهمة حماية المرضى والنهوض بالصحة العامة مع تعزيز الابتكار والتكيف بشكل واسع مع التطورات السريعة في مجالات الطب والعلوم والتكنولوجيا.
دراسة حالة: كيف يمكن للتعلم الآلي أن يساعد في تقليل الاختناقات في التجارب السريرية
حتى الآن، رأينا أن استخدام الذكاء الاصطناعي في تطوير الأدوية له الكثير من الإمكانات والفرص. ولكن كيف تستفيد الشركات من ذلك بالضبط؟ لقد حان الوقت لاستكشاف مثال من العالم الحقيقي يجلب النظرية إلى المجال العملي، ويسلط الضوء على التأثير الملموس للذكاء الاصطناعي.
تولد الدراسات قبل السريرية كميات كبيرة من البيانات المرضية، مما يجعل التحليل المرضي مستهلكًا للوقت. للامتثال لمعايير سلامة الأدوية الصارمة، يقوم عميلنا، وهو شركة أدوية عالمية، بتحليل الآلاف من صور الشرائح الكاملة كجزء من عملية تقييم السمية. في كل دراسة، يجب على أخصائيي علم الأمراض العثور على الآفات الدقيقة وتسجيلها على ما يقرب من 1600 شريحة، يبلغ قياس كل منها 200 مليون بكسل (أي 23 مترًا في 23 مترًا). ومع ذلك، فإن حوالي 70٪ من الشرائح لا تحتوي على أي آفات. لذلك يبحث أخصائيو علم الأمراض في معظم الأوقات عن الشرائح العادية.
.avif)
وللحد من هذا الاختناق، قمنا بتطوير نموذج التعلم الآلي الذي يحدد الشرائح الصحية ويرفضها تلقائيًا باستخدام أحدث تقنيات الرؤية الحاسوبية وبيانات علم الأمراض الرقمية. يوفر النموذج خرائط حرارية على شرائح الأنسجة لتسليط الضوء على المناطق المعرضة للآفات لأخصائيي علم الأمراض الخبراء، مما يجعل تحليلهم أكثر دقة وكفاءة. للحصول على فهم أكثر شمولاً، تحقق من هذا الفيديو.
مستقبل تطوير الأدوية المدعوم بالذكاء الاصطناعي
يعمل الذكاء الاصطناعي بالفعل على تحويل سلسلة القيمة لتطوير الأدوية، مما يوفر إمكانات هائلة لزيادة الكفاءة وخفض التكاليف وتسريع اكتشاف وتطوير الأدوية المنقذة للحياة.
وفي حين تقوم بعض شركات الأدوية بتفكيك فوائد الذكاء الاصطناعي بشكل أسرع من غيرها، من خلال إيجاد التوازن بين التعرف على فرص تقنيات الذكاء الاصطناعي ومخاطرها المحتملة، فإن الأمر مجرد مسألة وقت حتى يتم دمجها بالكامل في عملية تطوير الأدوية.

%20(1).png)
